SOMMAIRE
Il y a environ 2 milliards d’années, au moment où l’agitation thermique de la Terre se calmait, les cyanobactéries ont enrichi l’atmosphère en oxygène grâce à la photosynthèse. Ces premiers organismes unicellulaires, entre végétaux et animaux, ont développé un mécanisme d’oxydation, devenant ainsi les précurseurs de la respiration.
En parallèle, les archées, des bactéries des fonds marins, produisaient de l’énergie par fermentation, sans oxygène. Dans une symbiose bénéfique, les cyanobactéries ont intégré les archées, formant les mitochondries et les cellules eucaryotes, dont nous descendons. Cette collaboration a marqué un tournant évolutif majeur dans l’émergence de la vie sur Terre.
Les mitochondries disposent d’un ADN spécifique, l’ADNmt, transmis uniquement par la mère et dont toute mutation génère des conséquences majeures sur la santé.
Le rôle des mitochondries
☞ les mitochondries sont nos « centrales nucléaires » elles s’ assurent une grande partie des fonctions de transformation des nutriments en énergie (ATP), et ce en présence d’oxygène. Les mitochondries sont des moteurs hybrides, elles utilisent divers carburants tels que les acides gras, corps cétoniques et glucose.
Contrairement à la croyance populaire, les acides gras, plutôt que le glucose, sont le principal combustible des mitochondries, fournissant jusqu’à quatre fois plus d’énergie. Les acides gras saturés à chaine courte et moyenne sont rapidement absorbés, allant directement aux mitochondries pour une production d’énergie instantanée. Les acides gras saturés et mono-insaturés sont des carburants énergétiques efficaces, tandis que les acides gras poly-insaturés en excès ne peuvent pas être brûlés par la mitochondrie, ils ne sont pas recyclés et deviennent néfaste.
☞ Les mitochondries contrôlent les cellules déviantes afin de leur imposer le « suicide » lorsqu’elles deviennent problématiques (apoptose)
☞ Les mitochondries permettent de s’adapter à notre environnement, ce sont grâce à elles que nos ancêtres chasseurs-cueilleurs ont pu s’adapter aux changements de disponibilité alimentaire et de température en fonction des différents flux migratoires1. Ce phénomène est également appelé mitohormèse ou hormèse mitochondriale, il est d’une importance cruciale car il permet d’expliquer les impacts de divers facteurs liés au mode de vie sur la santé2.
Les dysfonctionnements mitochondriaux
Lorsque les mitochondries sont saines, vous êtes généralement en forme et en bonne santé mais lorsque qu’elles sont en sous régime vous êtes fatigués associés très souvent à des troubles cognitifs.
Après la quarantaine et selon notre hygiène de vie, le métabolisme commence à ralentir, la baisse du rendement énergétique induit, associé à une augmentation du stress oxydant et de l’inflammation, vont impacter le fonctionnement de la thyroïde augmentant fortement l’incidence de pathologies telles que le syndrome de fatigue chronique, les fibromyalgies, le diabète, l’obésité, et au cours du vieillissement, la sarcopénie, les maladies neurodégénératives, les cancers, l’athérosclérose et les maladies cardiovasculaires.
Dans le schéma ci-dessous je vous présente quelques liens physiologique de l’impact d’une mitochondrie dysfonctionnante :
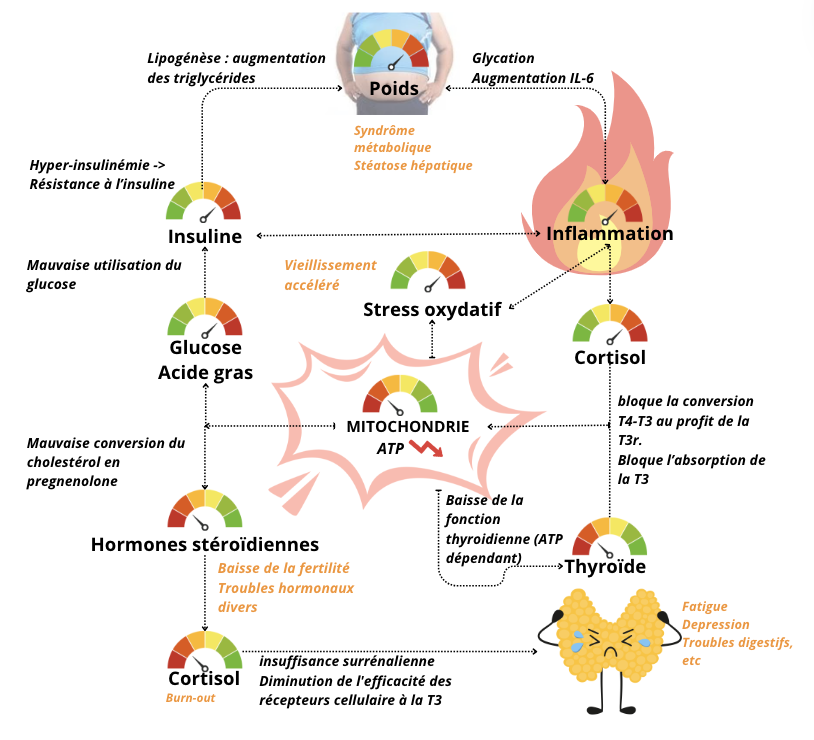
Pourquoi nos mitochondries se mettent-elles à dysfonctionner ?
En raison principalement d’une hyper-oxydation ! Les mitochondries sont un haut lieu de réactions oxydatives, mais prévues par la nature et parfaitement contrôlées par un métabolisme sain. Le problème est l’hyper-oxydation qui altère la fonction mitochondriale, et induit l’apoptose (mort) de ces organites cellulaires.
Quelles sont les sources d’une hyper-oxydation ?
Voici les deux principales :
☞ La glycation la glycation induit par un excès de sucres (glucose, fructose, farines et autres amidons) est une grande source d’oxydation et de production de molécules oxydatives fortement cancérigènes. L’entretien, la régénération, la production de nouvelles mitochondries (biogenèse), et la destruction de celles dysfonctionnantes (mitophagie) sont stimulés par la privation de glucose et l’augmentation d’acides gras (simulation de la voie AMPK et inhibition de mTOR)3.
☞ La consommation d’huiles végétales polyinsaturées ou de compléments alimentaires (omega-3). C’est pour une grande part de la population la plus grande cause d’une hyper-oxydation. Les acides gras polyinsaturés sont à longue et très longue chaine de carbones, et présentent plusieurs doubles liaisons qui les rendent très instables, très sensibles à l’oxygène, contrairement aux acides gras saturés et mono-insaturés qui sont très stables et pas, ou peu, sensibles à l’oxygène. Ces acides gras poly-insaturés en excès causent une peroxydation lipidique, induisant un stress oxydatif endommageant les mitochondries.
Ces deux sources d’hyper-oxydation sont malheureusement cumulées chez la plupart des consommateurs aujourd’hui. La dysfonction et la destruction mitochondriale sont alors inéluctables.
D’autres sources d’oxydation sont aussi à considérer :
- Le manque de connexion à la terre pour maintenir l’équilibre Redox via l’apport en électron.
- Les rayonnements électromagnétiques qui augmentent le stress oxydatif et diminue les niveaux de mélatonine (anti-oxydant mitochondrial majeur)
- La sédentarité influence négativement le nombre et la performance des mitochondries.
Que faire pour booster ses mitochondries
Hygiène alimentaire
Donner à vos mitochondries les carburants qui correspondent à leur physiologie avec une alimentation ancestrale riche en densité nutritive :
Macronutriment
☞ Lipides : Augmenter votre part d’acide gras à longue chaine (acide stéarique).
En termes de quantité d’énergie produite (ATP) par molécule métabolisée, les acides gras produisent plus d’ATP par molécule (environ 4x plus) que les glucides dans le cycle de Krebs et la phosphorylation oxydative. L’oxydation des acides gras dans la mitochondrie se fait principalement par la β-oxydation, qui est relativement efficace et produit moins de ROS par unité d’énergie produite par rapport à la glycolyse des glucides.
Supprimer les acides gras poly-insaturé issus des huiles de graine et des huiles de poisson.
Ces huiles hautement réactives à l’oxygène « brûlent » la totalité des antioxydants qui viennent à l’encontre de cette masse insensée d’acides gras oxydés qui n’existe pas dans la nature ! Leur peroxydation lipidique conduit à la formation de ROS qui endommage la mitochondrie.
Prenez votre ratio d’acides gras poly-insaturés omega-3 (EPA/DHA) en consommant des produits animaux : oeufs, viandes, poissons gras, etc.
☞ Glucide : Diminuer fortement la part de glucide (amidon, fructose, glucose). La glycolyse génère des quantités significatives de radicaux libre (ROS), en particulier dans des conditions de stress oxydatif ou de dysfonctionnement mitochondrial.
☞ Protéines : Manger des protéines animales de qualité, la mitochondrie a besoin d’acides aminés pour transporter les substrats dans la mitochondrie pour faire fonctionner le cycle de Krebs et protéger la mitochondrie du stress oxydatif
Micronutriments
- Vitamines du groupe B : B1,2,3,5,6,
- Fer (ni trop, ni trop peu),
- Magnésium,
- coenzyme Q10,
- zinc, manganèse, cuivre, sélénium, carnitine, taurine
Pratiquer l’hormèse
C’est par la capacité des mitochondries à répondre au stress de l’environnement qu’homosapiens a évolué. Un stress modéré favorise l’adaptation des mitochondries alors que le même stress, trop important par rapport à la capacité cellulaire d’un individu à un moment donné, altère leur fonctionnement et majore le stress oxydatif.
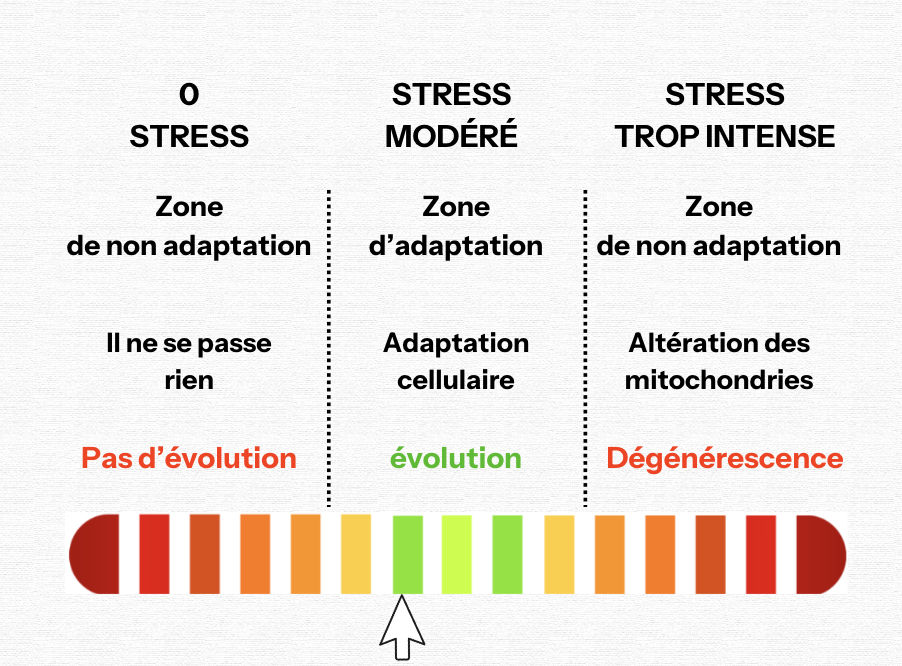
On parle de mitohormèse ou d’hormèse mitochondriale. Ce principe est essentiel car il permet d’expliquer les effets de nombreux facteurs liés au mode de vie sur la santé.
La pratique de l’hormèse va favoriser la biogénèse mitochondriale :
- Exercice physique de type HIIT,
- Pratique du sauna,
- Jeûne,
- Pratique du bain froid (transformation de la graisse blanche en graisse brune),
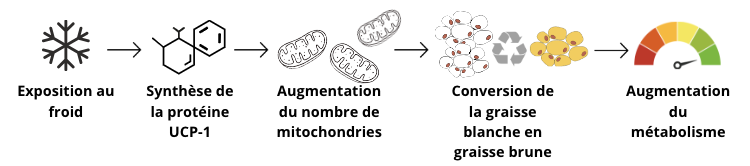
Plus on a de graisse brune, plus on a la capacité de brûler du tissu adipeux parce que notre métabolisme s’élève et nous produisons plus de chaleur et d’énergie. Nous augmentons ainsi la dépense énergétique et le taux métabolique.
Avoir un bon niveau de mélatonine
Tu veux savoir comment ? voir mon article ici
La diminution entre autre de votre exposition au champ électromagnétique. La mélatonine protège la mitochondrie4 en piégeant les dérivés réactifs de l’oxydation, elle maintient l’intégrité et le potentiel optimal de la membrane mitochondriale, et assure la biogenèse et la dynamique de la mitochondrie. La mélatonine augmente aussi l’autophagie, c’est-à-dire qu’elle permet à la cellule de se débarrasser des éléments toxiques qui y pénètrent (métaux lourds, bactéries, virus, etc.).
S’exposer aux infra-rouges
Les mitochondries sont très sensibles aux longueurs d’onde de lumière rouge ou proche infrarouge, cela stimule la chaine respiratoire mitochondriale dans le but d’optimiser la production d’ATP et l’adaptation au stress oxydatif. C’est le principe de la photosynthèse des plantes qui utilise l’énergie issue des photons.
Les lumières rouge et proche infrarouge stimulent une protéine spécifique de la chaîne respiratoire, la cytochrome C oxydase (ou complexe IV)5
Les longueurs d’onde optimales pour la stimulation de la cytochrome C oxydase semblent se situer entre 610 et 690 nm pour la lumière rouge et entre 750 et 845 nm pour le proche infrarouge6
Plusieurs sociétés proposent des dispositifs à base de LED permettant de s’exposer quotidiennement à la lumière rouge et proche infrarouge. Je ne conseils pas ces dispositifs. Préférez une exposition à la lumière naturelle, le spectre solaire est votre meilleure source d’infrarouge. Sortez à l’extérieur autant que possible (les rayonnements IF sont bloqués en grande partie par les fenêtres). Vous pouvez en fin de journée utiliser des ampoules à incandescence (veiller à atteindre de 250 à 500 watts d’exposition), utiliser des bougies ou un feu de cheminée pour vous éclairer.
Certaines pratiques ayant recours à des saunas spécifiques, comme la méthode Waon, utilisent quant à eux les ondes infrarouges à l’origine de la production de chaleur, notamment en cas de fatigue chronique ou d’inflammation chronique7.
Pratiquer le earthing
Les électrons permettent de maintenir l’équilibre oxydatif de la mitochondrie et son bon fonctionnement.
Eviter le plus possible les autres sources toxiques :
☞ Les rayonnements électromagnétiques artificiels qui perturbent le fonctionnement de la chaîne respiratoire (voir mon article ici) et génèrent des modifications dans l’ADN mitochondrial8 à des radiofréquence de 1,8 GHz, une fréquence équivalente au wi-fi.
☞ Les pesticides, dioxines, phtalates, PCB, composés perfluorés, métaux lourds (mercure, le cadmium, l’aluminium et l’arsenic), certains émulsifiants (comme le polysorbate 80), l’excès d’alcool, les mycotoxines, toute supplémentation en fer et en cuivre sans avoir objectivé l’existence d’un déficit au préalable via une prise de sang.
Prise de compléments ciblés
Je ne préconise pas l’utilisation de compléments en première intention. La complémentation vient en un accompagnement de la mise en place des points cités ci-dessus, vous trouverez ci-dessous une liste de choix ciblés pour faciliter le re-boost de la mitochondrie, je vous conseils de réserver une consultation pour adapter ces solutions à votre besoin particulier.
☞ L’acide R alpha-lipoïque (ALA) :

L’acide alpha-llipoïque (AAL) naturellement présent dans la mitochondrie, stimule le rendement énergétique. Il agit également comme cofacteur de plusieurs enzymes clés dans la gestion de son potentiel redox9.
☞ Vitamines du groupe B

Les vitamines B sont des bougies d’allumage pour le métabolisme, en particulier B 12 , B 6 , la thiamine (B 1 ), la riboflavine (B2 ) et la niacine (B3 ). En soutien symbiotique, B12 est en grande partie responsable de la formation correcte de chaque cellule dans le corps, et B6 est nécessaire pour la digestion complète de toutes les protéines. Lorsque B2 et B3 sont utilisés dans le corps, ils se convertissent en FADH2 et NADH, éléments moléculaires clés du cycle de Krebs producteur d’ATP.
☞ Le magnésium

Le magnésium est un minéral qualifié d’ubiquitaire car il est nécessaire à de très nombreuses réactions enzymatiques du métabolisme énergétique, y compris au sein des mitochondries10.Plus précisément, la capacité de ces dernières à réguler leur taux de magnésium détermine de manière critique l’énergie cellulaire disponible et la vulnérabilité aux différents stimuli hormétiques11.
Pour les personnes qui ne mangent pas suffisamment de produits animaux :
☞ La co-enzyme Q10

Le CoQ10 est impliquée dans la production d’énergie et est abondante dans les organes comme le cœur qui nécessitent de grandes quantités d’énergie. Le CoQ10 est un complément chimique nécessaire à la survie des mitochondries. Avec l’âge, lorsque la production corporelle de CoQ10 diminue, un apport exogène ou alimentaire est nécessaire passé la cinquantaine.
Le CoQ10 représente un nutriment clé au bon fonctionnement de la chaîne respiratoire mitochondriale12
☞ L’acetyl-L-carnitin

Son rôle principal concerne le métabolisme lipidique, en tant que « super transporteur » des acides gras à longue chaîne au sein des mitochondries13
Si vous avez des besoins en complémentation demander l’avis d’un professionnel de santé
Conclusion
Vous l’avez compris, les mitochondries sont les moteurs de notre santé et de notre bien-être. Lorsqu’elles sont abîmées et qu’elles se mettent à dysfonctionner en raison d’une hyper-oxydation, plus rien ne tourne rond dans notre organisme, et les troubles métaboliques surviennent inévitablement dont très fréquemment de la fatigue chronique.
Les mitochondries sont la clés pour une santé optimisée. Pas de qualité de vie sans un nombre suffisant de mitochondries en bon état de fonctionnement !
Vous souhaitez retrouver votre énergie et retrouver un poids de forme?
Réservez votre consultation
ou demandez un appel découverte – je vous rappel gratuitement
Les informations que je fournis sur Naturosapiens ne sont pas des conseils médicaux et ne sont pas destinées à remplacer une consultation avec un professionnel de la santé. Veuillez informer votre médecin de tout changement que vous apportez à votre régime alimentaire ou à votre mode de vie et discuter de ces changements avec lui. Si vous avez des questions ou des inquiétudes au sujet de votre état de santé, veuillez contacter votre médecin.
Références :
- Tapia PC. Sublethal mitochondrial stress with an attendant stoichiometric augmentation of reactive oxygen species may precipitate many of the beneicial alterations in cellular physiology produced by caloric restriction, intermittent fasting, exercise and dietary phytonutrients: “Mitohormesis” for health and vitality. Medical Hypotheses. 2006;66(4):832-843. doi:10.1016/j.mehy.2005.09.009 [↩]
- Le concept de mitohormèse décrit les effets d’un stimulus unique, appelé stresseur, sur le fonctionnement mitochondrial, pouvant être bénéfique ou préjudiciable en fonction de son intensité et de sa durée. En d’autres termes, un stress modéré favorise l’adaptation des mitochondries, tandis qu’une intensité excessive, dépassant la capacité cellulaire individuelle à un moment donné, altère leur fonctionnement et accentue le stress oxydatif [↩]
- Jordana B Freemantle, D Grahame Hardie, AMPK promotes lysosomal and mitochondrial biogenesis via folliculin:FNIP1, Life Metabolism, Volume 2, Issue 5, October 2023, load027, https://doi.org/10.1093/lifemeta/load027 [↩]
- Tan DX, Manchester LC, Qin L, Reiter RJ. Melatonin: A Mitochondrial Targeting Molecule Involving Mitochondrial Protection and Dynamics. Int J Mol Sci. 2016 Dec 16;17(12):2124. doi: 10.3390/ijms17122124. PMID: 27999288; PMCID: PMC5187924. [↩]
- de Freitas, L. F.; Hamblin, M. R. Proposed Mechanisms of Photobiomodulation or Low-Level Light Therapy. IEEE J SelTop Quantum Electron 2016, 22 (3). https://doi.org/10.1109/JSTQE.2016.2561201. [↩]
- Karu, T. I.; Kolyakov, S. F. Exact Action Spectra for Cellular Responses Relevant to Phototherapy. Photomed Laser Surg 2005, 23 (4), 355-361. https://doi.org/10.1089/pho.2005.23.355. [↩]
- Chriett S, Dąbek A, Wojtala M, Vidal H, Balcerczyk A, Pirola L. Prominent action of butyrate over β-hydroxybutyrate as histone deacetylase inhibitor, transcriptional modulator and anti-inlammatory molecule. Sci Rep. 2019;9(1):742. doi:10.1038/s41598-018-36941-9
Ruskin DN, Jr MK, Masino SA. Reduced Pain and Inlammation in Juvenile and Adult Rats Fed a Ketogenic Diet. PLOS ONE. 2009;4(12):e8349. doi:10.1371/journal.pone.0008349Nakamura K, Tonouchi H, Sasayama A, Ashida K. A Ketogenic Formula Prevents Tumor Progression and Cancer Cachexia by Attenuating Systemic Inlammation in Colon 26 Tumor-Bearing Mice. Nutrients. 2018;10(2). doi:10.3390/nu10020206
Offermanns S, Schwaninger M. Nutritional or pharmacological activation of HCA2 ameliorates neuroinlammation.Trends in Molecular Medicine. 2015;21(4):245-255. doi:10.1016/j.molmed.2015.02.002 [↩]
- De Iuliis GN, Newey RJ, King BV, Aitken RJ. Mobile phone radiation induces reactive oxygen species production and DNA damage in human spermatozoa in vitro. PLoS One. 2009 Jul 31;4(7):e6446. doi: 10.1371/journal.pone.0006446. Erratum in: PLoS One. 2013;8(3). doi:10.1371/annotation/9a8a0172-3850-4059-b852-72c330769c1b. PMID: 19649291; PMCID: PMC2714176. [↩]
- McLain AL, Szweda PA, Szweda LI. α-Ketoglutarate dehydrogenase: a mitochondrial redox sensor. Free Radic Res. 2011;45(1):29-36. doi:10.3109/10715762.2010.534163
Solmonson A, DeBerardinis RJ. Lipoic acid metabolism and mitochondrial redox regulation. J Biol Chem.2018;293(20):7522-7530. doi:10.1074/jbc.TM117.000259 [↩]
- Shindo Y, Fujii T, Komatsu H, et al. Newly developed Mg2+-selective luorescent probe enables visualization of Mg2+ dynamics in mitochondria. PLoS One. 2011;6(8):e23684. doi:10.1371/journal.pone.0023684 [↩]
- R Y, S T, Y S, et al. Mitochondrial Mg(2+) homeostasis decides cellular energy metabolism and vulnerability to stress. Scientiic reports. 2016;6. doi:10.1038/srep30027 [↩]
- Laredj LN, Licitra F, Puccio HM. The molecular genetics of coenzyme Q biosynthesis in health and disease. Biochimie.2014;100:78-87. doi:10.1016/j.biochi.2013.12.006 [↩]
- Bremer J. Carnitine–metabolism and functions. Physiol Rev. 1983;63(4):1420-1480. doi:10.1152/phys- rev.1983.63.4.1420
Geier DA, Geier MR. L-carnitine exposure and mitochondrial function in human neuronal cells. Neurochem Res.2013;38(11):2336-2341. doi:10.1007/s11064-013-1144-7 [↩]







